16
2025
-
05
“靶”握先机 |关键靶点GHS-R1a成焦虑症治疗新突破!
焦虑症是全球范围内困扰数亿人的精神疾病,但现有治疗手段效果有限且副作用明显。
焦虑症是全球范围内困扰数亿人的精神疾病,但现有治疗手段效果有限且副作用明显。
2025年4月24日,一篇发表于《Nature》的研究GHS-R1a signaling drives anxiety-related behavior by shaping excitability of ventromedial hypothalamic neurons.揭示了代谢相关受体GHS-R1a在焦虑发生中的关键作用,为开发新型抗焦虑药物提供了重要靶点。
一、靶点概述
:从饥饿激素到情绪调控
GHS-R1a是胃饥饿素(ghrelin)的主要受体,传统认知中主要调控食欲和能量代谢。但新研究发现,它在大脑情绪调节中枢——下丘脑腹内侧核(VMH)中异常活跃。研究团队通过基因编辑小鼠模型发现,慢性压力会导致VMH区αCaMKII神经元中GHS-R1a表达激增,这种上调与焦虑行为发展同步出现,具有显著延迟效应(压力暴露后6天才达峰值);人为增加GHS-R1a表达的小鼠表现出更严重的焦虑样行为。
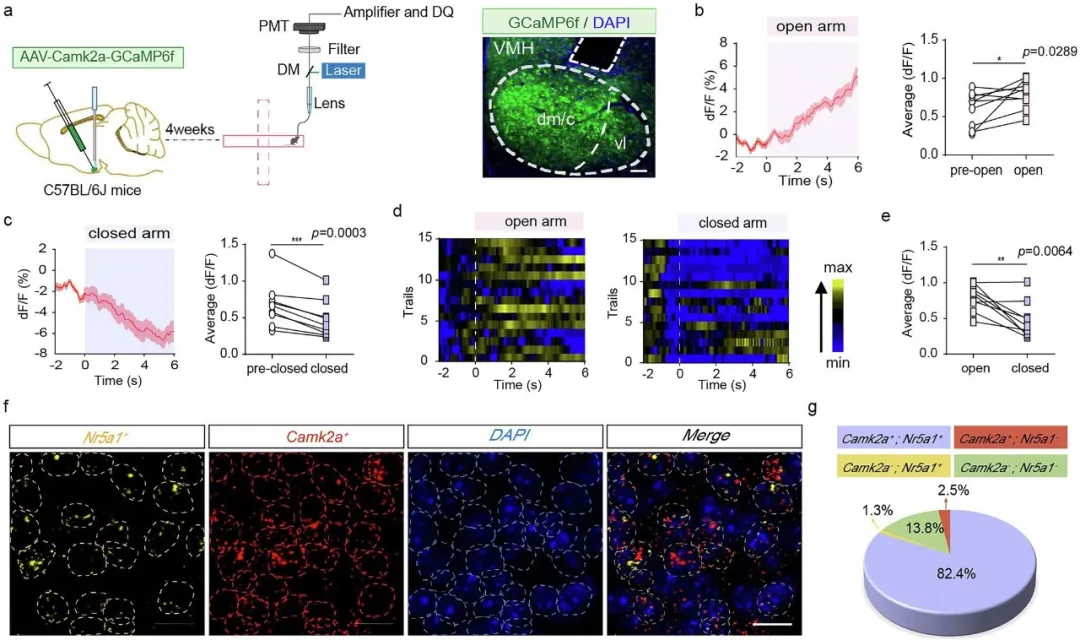
(图片来自参考文献)
二、研究亮点:动物模型中的突破性发现
研究团队建立了反复束缚应激(RRS)模型,模拟人类慢性压力状态发现小鼠经历4天、每天1小时的束缚应激后,表现出典型的焦虑行为。
关键发现——压力导致的GHS-R1a上调具有脑区特异性(在VMH显著,而在伏隔核无变化);靶向敲除该受体可使小鼠在压力下保持正常情绪状态。
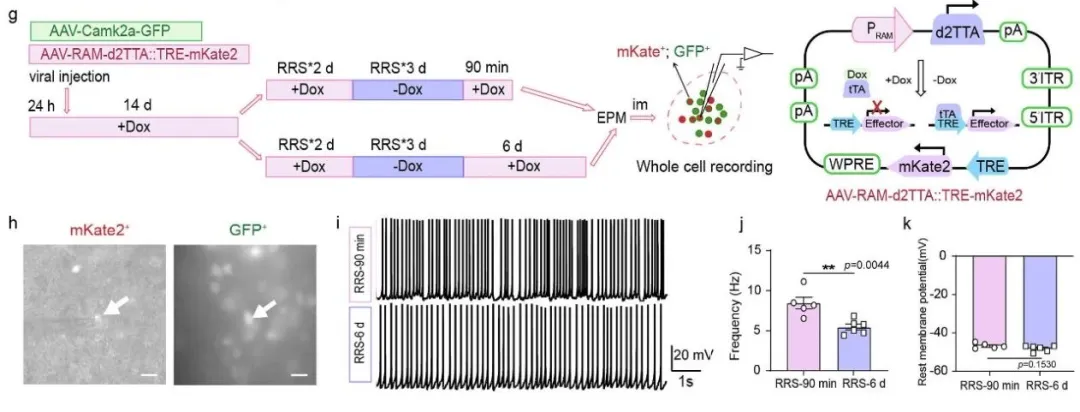
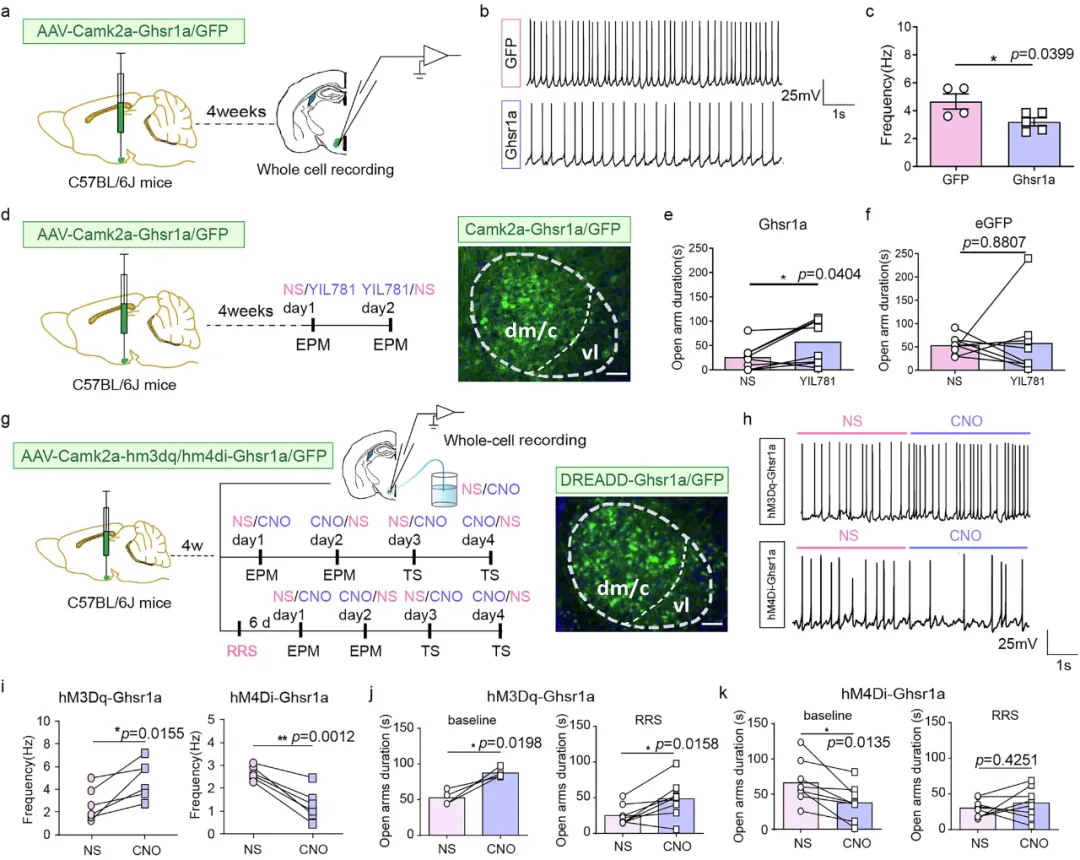
(图片来自参考文献)
三、机制解析:神经兴奋的隐形开关
研究采用光遗传学、化学遗传学等前沿技术,揭示GHS-R1a通过调控神经元活动影响焦虑的分子机制:
双向调控实验:激活VMH区αCaMKII神经元可缓解焦虑,抑制则加剧。
电生理证据:GHS-R1a过表达显著降低神经元放电频率,抑制神经兴奋性。
药理学验证:局部注射GHS-R1a拮抗剂YIL781可逆转焦虑表型。
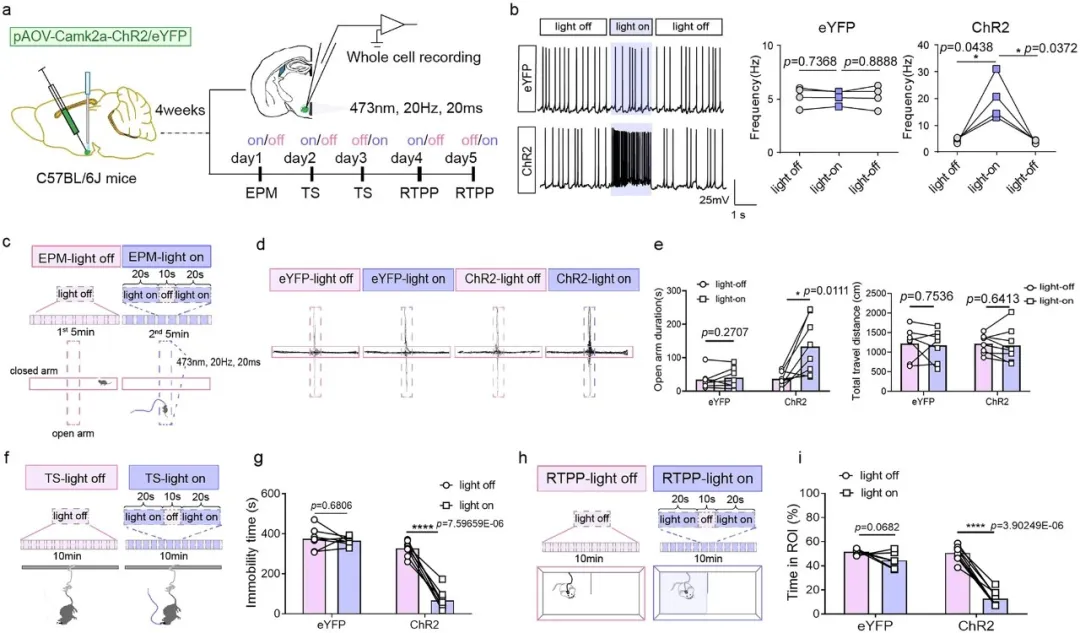
(图片来自参考文献)
四、临床转化:未来或可实现“一药双效”
相较于现有疗法,GHS-R1a展现出独特优势:
诊断价值——GHS-R1a表达水平或成焦虑症生物标志物
治疗新策略——开发选择性GHS-R1a拮抗剂,避免全身给药副作用
精准干预——针对下丘脑-杏仁核神经环路进行靶向治疗
这项研究首次将代谢受体与情绪障碍直接关联,揭示了压力-饥饿素系统-神经可塑性的级联反应机制。GHS-R1a作为可成药靶点,为开发速效、低副作用抗焦虑药指明方向。同时研究团队已着手开发血脑屏障穿透性GHS-R1a调节剂。下一步将探索该受体在不同焦虑亚型(广泛性焦虑、PTSD等)中的特异性作用、与其他神经递质系统(如5-HT、GABA)的交互作用、基于人工智能的新型化合物筛选等方向。
这项突破性研究不仅革新了我们对焦虑发生机制的理解,更为精准医疗时代的精神疾病治疗提供了全新靶点。期待相关药物早日进入临床转化,为亿万焦虑患者带来曙光!

参考文献:
Zhang, M., Yang, L., Mi, X. et al. GHS-R1a signaling drives anxiety-related behavior by shaping excitability of ventromedial hypothalamic neurons. Nat Commun 16, 3858 (2025). https://doi.org/10.1038/s41467-025-59116-3
声明:文章转载分享,不做商业用途,如有侵权,请联系删除
关于溪长生物
溪长生物是一家新兴的生物技术公司,专注于抗体发现与早研一站式服务,旨在助力医药行业降本增效。成立于2023年7月,公司汇聚了来自上海交大、复旦大学等知名学府的专家,拥有超过15年的生物制药经验,2024年完成了数千万天使轮融资。溪长生物建立了六大技术平台,提供从抗体设计到规模化生产的全流程服务。公司创始团队在抗体人源化、改造、蛋白抗体制备等方面具有领先技术,计划到2026年建立千亿级全人源Fab合成文库,为制药和诊断行业提供高亲和力、高特异性的候选抗体,目标是填补国产替代空间,推动国内医药行业的自主创新和产业升级,最终实现国产化,提高产品的可及性,造福患者。

关键词:
对照药 | 抗药抗体 | 仪器 | 试剂



