09
2025
-
05
“靶”握先机 |独立于PD-1的新型免疫检查点ITPRIPL1(CD3L1)
在 T 细胞主导的抗肿瘤免疫反应体系中,T 细胞受体(TCR)-CD3 复合体处于关键枢纽地位,但学界对其天然抑制型配体的研究却长期处于空白状态。

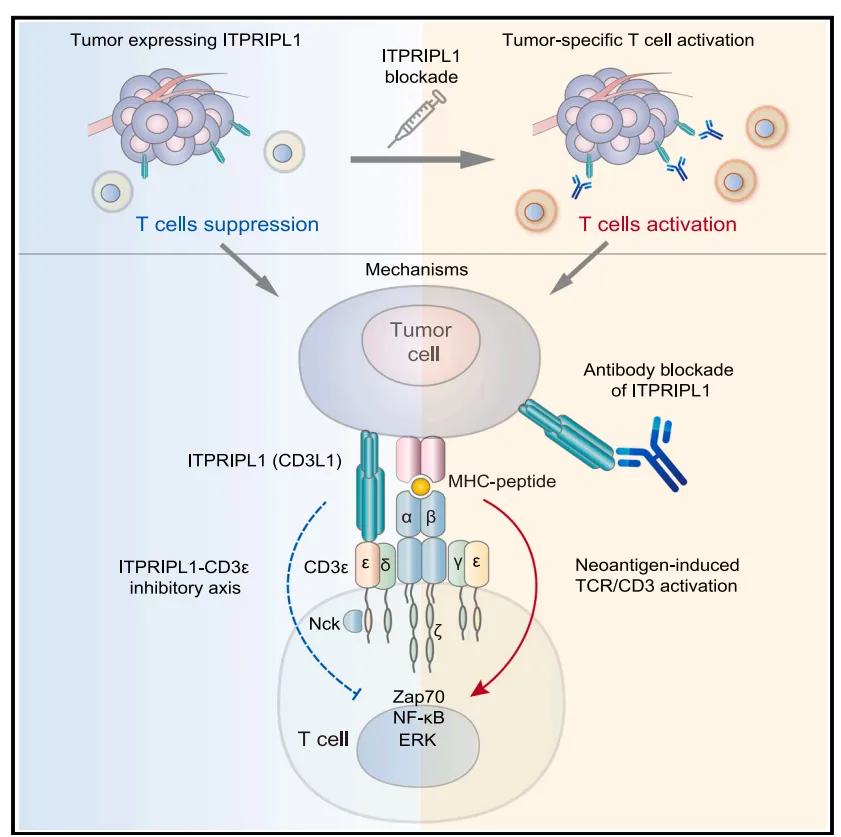
在 T 细胞主导的抗肿瘤免疫反应体系中,T 细胞受体(TCR)-CD3 复合体处于关键枢纽地位,但学界对其天然抑制型配体的研究却长期处于空白状态。复旦大学许杰教授团队在《Cell》发表重磅研究,首次揭示肿瘤免疫逃逸新机制——ITPRIPL1(CD3L1)通过直接结合T细胞表面CD3ε,抑制TCR信号传导,成为独立于PD-1/PD-L1的全新免疫检查点,阻断该靶点的抗体疗法在多癌种及宠物自发肿瘤中展现惊人疗效。
一、靶点概述:
双面蛋白ITPRIPL1
ITPRIPL1(又称CD3L1)是一种新型免疫检查点蛋白,具有独特双重身份,其生理状态下在睾丸(免疫豁免器官)高表达,维持局部免疫耐受;病理状态下该分子在多种实体瘤(如肺癌、结直肠癌、黑色素瘤)中异常过表达,且与PD-L1呈现显著互斥模式,成为PD-1/PD-L1疗法无效或耐药肿瘤的“替代逃逸通路”。作为CD3ε的首个天然抑制性配体,ITPRIPL1可直接靶向T细胞活化核心信号,从源头阻断抗肿瘤免疫应答。
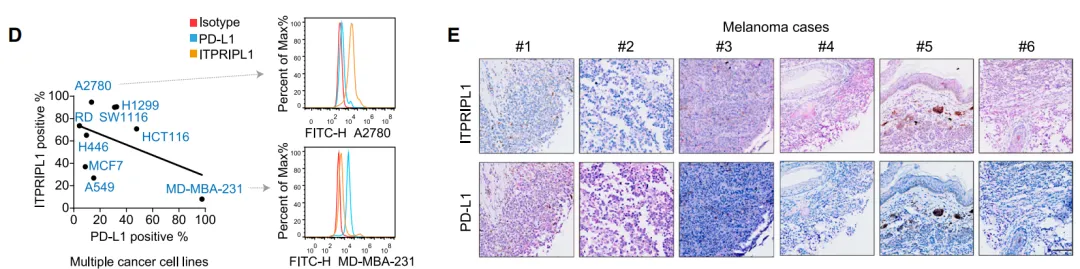
(图片来自参考文献)
二、研究亮点:解密抑制信号传导的分子密码
首次揭示ITPRIPL1作为CD3ε的抑制性配体,开辟独立于PD-1的全新免疫调节轴。传统免疫检查点(如PD-1)作用于T细胞激活的"共刺激信号",而ITPRIPL1直接靶向TCR-CD3复合体的核心组件CD3ε,从源头阻断T细胞活化。
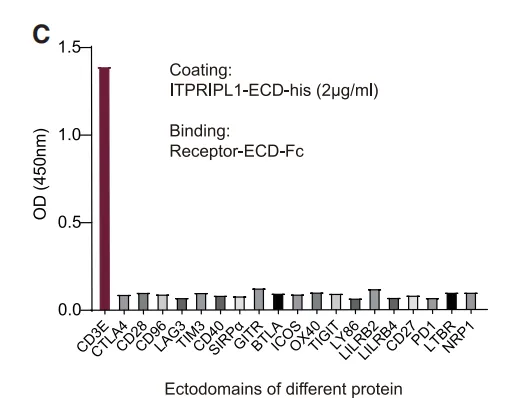
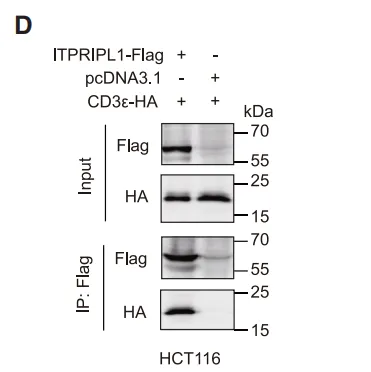
(图片来自参考文献)
精准锁定耐药群体:ITPRIPL1高表达与PD-1治疗失败显著相关,为精准分型提供新标志物。
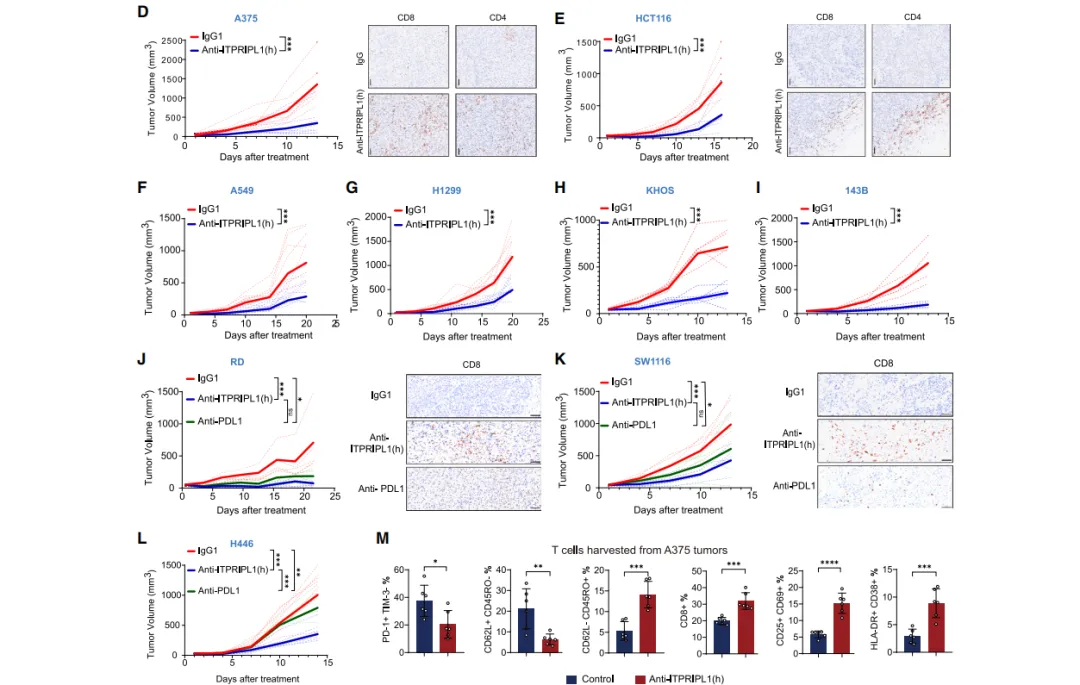
跨物种验证:抗体疗法在宠物自发肿瘤中疗效显著,6只治疗犬肿瘤体积平均缩小52%;小鼠模型中MC38结直肠癌、B16黑色素瘤等肿瘤生长抑制率达70%。
双通路潜力:与PD-L1互斥表达,联合治疗或成“免疫双刹车”破解方案。
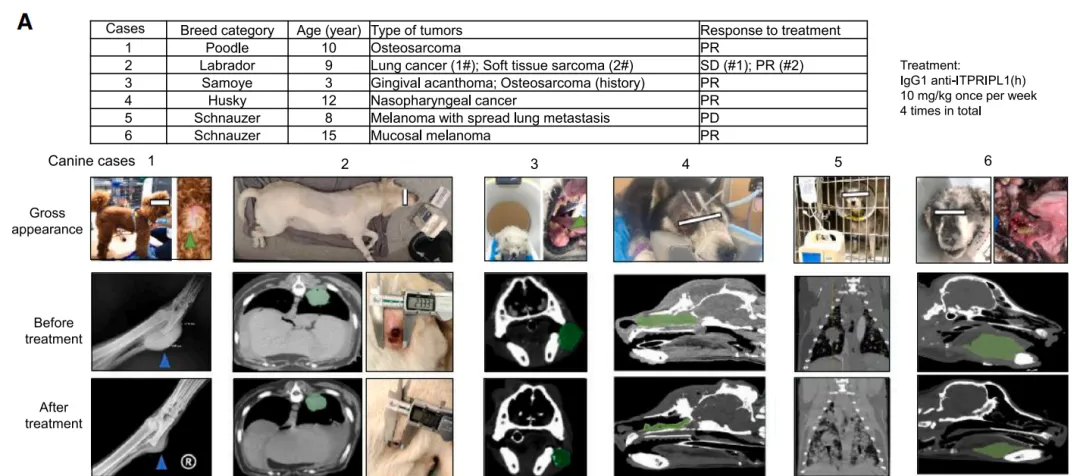
(图片来自参考文献)
三、机制解析:从源头扼杀T细胞激活
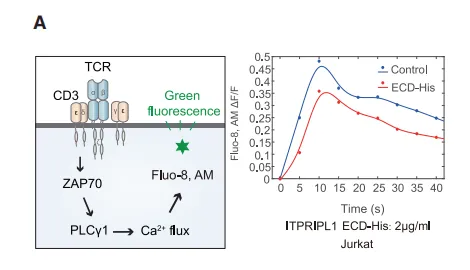
ITPRIPL1如何“瘫痪”T细胞?ITPRIPL1结合CD3ε胞外域,阻碍TCR信号传导“第一步”↓钙内流、↓ZAP70/ERK磷酸化,抑制T细胞活化关键信号通过稳定CD3ε-Nck结合,阻止信号复合体构象变化。
(图片来自参考文献)
(1)靶向T细胞激活“开关”
结合CD3ε胞外域,阻碍TCR信号复合体构象变化
抑制钙离子内流(下降60%)及ZAP70磷酸化(降低75%)
(2)信号传导“致命干扰”
稳定CD3ε-Nck结合,阻断ZAP70招募(共定位信号减少3倍)
下调NF-κB通路活性,抑制IL-2、IFN-γ等效应分子分泌
(图片来自参考文献)
(3) 重塑肿瘤微环境
ITPRIPL1过表达肿瘤中CD8+ T细胞浸润降低80%
耗竭标记PD-1+TIM3+ T细胞比例增加2.5倍
(图片来自参考文献)
四、临床转化:加速转化打破耐药困局
CD3L1抗体治疗肿瘤的临床试验已经顺利获得美国FDA和中国NMPA的新药临床研究(IND)许可,并处于临床研究阶段。CD3L1的发现改写了肿瘤免疫逃逸的教科书认知,其抗体疗法展现出“破冰”免疫治疗耐药困局的巨大潜力。
随着临床转化加速,这一靶点有望成为继PD-1后的下一代免疫治疗基石,为更多患者点燃生命希望。未来,针对ITPRIPL1的联合疗法、双抗设计及伴随诊断体系,或将开启精准免疫治疗2.0时代!

参考文献:Deng S, Zhang Y, Wang H, et al. ITPRIPL1 binds CD3ε to impede T cell activation and enable tumor immune evasion. Cell. 2024;187(9):2305-2323.e33.
DOI: 10.1016/j.cell.2024.03.019
声明:文章转载分享,不做商业用途,如有侵权,请联系删除
关于溪长生物
溪长生物是一家新兴的生物技术公司,专注于抗体发现与早研一站式服务,旨在助力医药行业降本增效。成立于2023年7月,公司汇聚了来自上海交大、复旦大学等知名学府的专家,拥有超过15年的生物制药经验,2024年完成了数千万天使轮融资。溪长生物建立了六大技术平台,提供从抗体设计到规模化生产的全流程服务。公司创始团队在抗体人源化、改造、蛋白抗体制备等方面具有领先技术,计划到2026年建立千亿级全人源Fab合成文库,为制药和诊断行业提供高亲和力、高特异性的候选抗体,目标是填补国产替代空间,推动国内医药行业的自主创新和产业升级,最终实现国产化,提高产品的可及性,造福患者。

关键词:
对照药 | 抗药抗体 | 仪器 | 试剂



