27
2025
-
03
“靶”握先机 |下一个PD-1?探索SOX17靶点
免疫系统是人体对抗肿瘤的核心防线,但癌细胞常通过“免疫逃逸”机制伪装自身,逃避免疫细胞的识别与攻击。目前,以PD-1/PD-L1抑制剂为代表的免疫检查点疗法虽在晚期癌症中取得突破,但对早期肿瘤(如结直肠癌)效果有限。
一、癌症免疫逃逸:一场“猫鼠游戏”的生物学难题
免疫系统是人体对抗肿瘤的核心防线,但癌细胞常通过“免疫逃逸”机制伪装自身,逃避免疫细胞的识别与攻击。目前,以PD-1/PD-L1抑制剂为代表的免疫检查点疗法虽在晚期癌症中取得突破,但对早期肿瘤(如结直肠癌)效果有限。科学家们一直在寻找:肿瘤如何在早期阶段就“蒙蔽”免疫系统?一篇发表于《Nature》的研究揭示了关键答案——转录因子SOX17,这一分子被证实是早期结直肠癌免疫逃逸的核心“操纵者”,为癌症免疫治疗提供了全新视角。
二、SOX17:从胚胎发育到癌症的“多面手”
SOX17属于SOX(SRY-related HMG-box)转录因子家族,在胚胎发育、血管生成及器官形成中发挥重要作用。既往研究发现,SOX17在多种实体瘤(如肝癌、胃癌)中异常高表达,但其在肿瘤免疫微环境中的功能尚不明确。
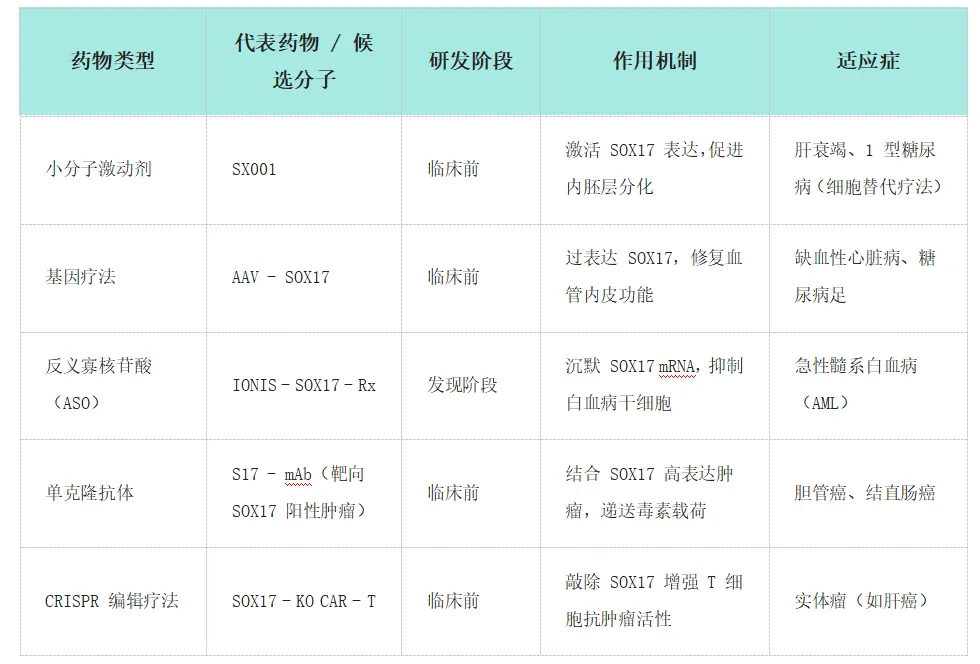
在研药物及分类 :
三、 SOX17介导的免疫逃逸机制在结直肠癌早期演进中的关键作用
(一)SOX17的肿瘤特异性诱导及其功能验证
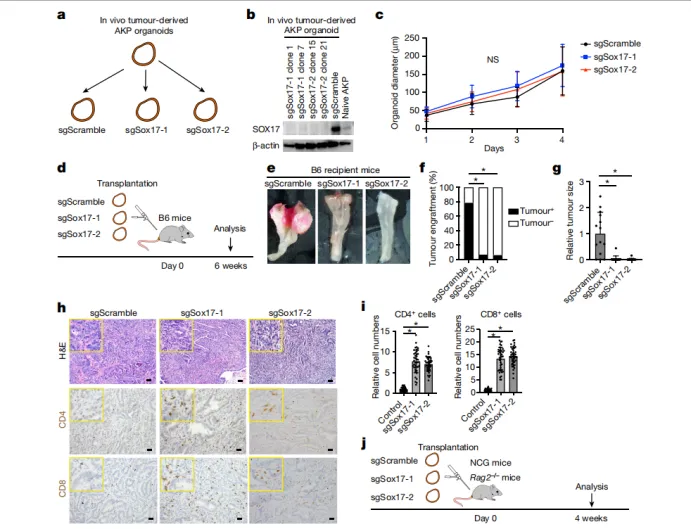
1. 通过结肠癌类器官原位移植模型发现,体内微环境驱动SOX17表达
·转录组与染色质可及性分析显示,SOX17在体内肿瘤中特异性上调,而在体外培养的类器官中不表达。
·免疫组化证实SOX17在移植瘤及自发Apc-null腺瘤中呈核阳性,正常肠上皮无表达。
·机制上,体内免疫压力(如T细胞)并非SOX17诱导的必要条件,提示肿瘤细胞自主的微环境信号驱动其表达。

(图片来自参考文献)
2. SOX17缺失导致免疫依赖性生长抑制
·CRISPR敲除SOX17的AKP类器官在体外增殖正常,但在免疫健全小鼠中原位移植后成瘤率下降至6%(vs 对照组80%)。
·免疫缺陷小鼠(NCG/Rag2-/⁻)中SOX17缺失不影响成瘤,表明其功能依赖于免疫逃逸。
(图片来自参考文献)
(二) SOX17调控免疫微环境的分子机制
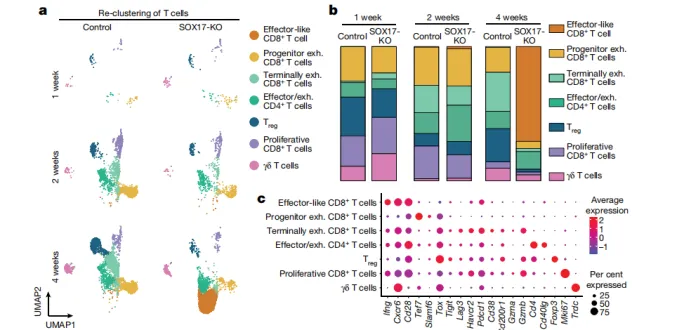
1. 抑制IFNγ信号通路:
·细胞测序显示SOX17缺失肿瘤中效应CD8⁺T细胞(IFNγ⁺TNF⁺)比例显著升高,而对照组以耗竭T细胞为主。
(图片来自参考文献)
·SOX17直接结合Ifngr1启动子(CUT&RUN验证),抑制IFNGR1表达,导致了MHC-I表达降低、CXCL10分泌减少。
·IFNγ中和抗体或IFNGR1敲除可逆转SOX17缺失肿瘤的免疫清除。
2. 驱动胎儿肠道程序与肿瘤异质性
·SOX17激活胎儿肠上皮基因特征,促进LGR5⁺肿瘤干细胞向LGR5⁻分化,LGR5⁻细胞MHC-I表达更低,具有免疫逃逸优势。
·体内谱系追踪显示SOX17缺失增加LGR5⁺细胞比例。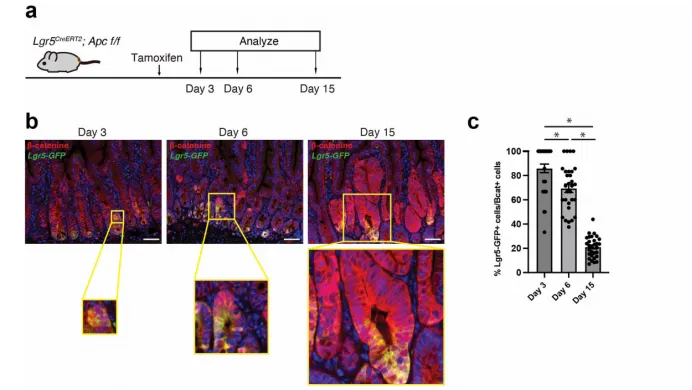
(图片来自参考文献)
简言之:SOX17如同给癌细胞穿上"隐身斗篷",通过两种方式逃避免疫追杀:
·关闭警报系统:抑制干扰素γ受体使免疫细胞无法识别癌细胞(类似切断火警报警器);
·伪装成正常细胞:激活胎儿期肠道发育程序,让癌细胞混入正常细胞群体;
四、临床相关性及治疗启示
1. 人类样本验证:
·19例腺瘤及pT1期结直肠癌均呈SOX17高表达,且与CD8⁺T细胞浸润负相关。
·临床意义:未来可通过检测粪便/血液中的SOX17,实现更早发现癌前病变;
2.靶向干预潜力
·诱导型shRNA敲低SOX17可抑制已形成肿瘤的生长。
·治疗展望:正在开发中的SOX17抑制剂,或可增强现有PD-1抑制剂疗效;
科学家说:"SOX17就像癌细胞的‘隐形开关’,我们的发现为早期干预提供了关键靶点。未来可能通过基因检测锁定高危人群,在癌变前就阻断这一通路。" ——Omer H. Yilmaz教授
参考文献:Goto N, Westcott PMK, Goto S, Imada S, Taylor MS, Eng G, Braverman J, Deshpande V, Jacks T, Agudo J, Yilmaz ÖH. SOX17 enables immune evasion of early colorectal adenomas and cancers. Nature. 2024 Mar;627(8004):636-645. doi: 10.1038/s41586-024-07135-3. Epub 2024 Feb 28. PMID: 38418875.
注:文章转载分享,不做商业用途,如有侵权,请联系删除
关键词:
对照药 | 抗药抗体 | 仪器 | 试剂



