05
2025
-
01
Xi闻|Antibodies to watch in 2025,国内自主研发申请上市抗体类产品11款
抗体疗法的商业开发是一项全球性的事业,涉及成千上万家生物制药公司和提供支持的服务机构。迄今为止,他们的共同努力已使超过 200 种抗体疗法上市,并且还有近 1400 种处于研发阶段的产品候选物正在临床试验中接受评估,用于治疗各种疾病。
抗体疗法的商业开发是一项全球性的事业,涉及成千上万家生物制药公司和提供支持的服务机构。迄今为止,他们的共同努力已使超过 200 种抗体疗法上市,并且还有近 1400 种处于研发阶段的产品候选物正在临床试验中接受评估,用于治疗各种疾病。在此,我们讨论了 2024 年抗体疗法开发中的关键事件,并预测了 2025 年可能与后期临床研发管线相关的关键事件。特别地,我们报告了 2024 年在至少一个国家或地区首次获批的 21 种抗体疗法,包括双特异性抗体 tarlatamab(IMDELLTRA®)、zanidatamab(Ziihera®)、zenocutuzumab(BIZENGRI®)、odronextamab(Ordspono®)、ivonescimab(依达方®)以及抗体药物偶联物(ADC)sacituzumab tirumotecan(佳泰莱®)。我们还讨论了截至我们最后一次更新时,至少有一个监管机构正在审查其上市申请的 30 种在研抗体疗法。2024 年 12 月 9 日,包括 ADC 药物 datopotamab deruxtecan、telisotuzumab vedotin、patritumab deruxtecan、trastuzumab botidotin、becotatug vedotin 和 trastuzumab rezetecan。在我们纳入的 178 种处于后期研发阶段的抗体疗法中,我们总结了 18 种可能在 2025 年底提交上市申请的关键数据,例如双特异性或多特异性抗体 denecimig、sonelokimab、erfonrilimab 和 anbenitamab。报告了双特异性抗体和 ADC 等抗体格式的开发和审批的关键趋势,以及这些抗体分子形式的临床阶段过渡和全球审批成功率。
我们分析了不同抗体分子形式的趋势和成功率,并根据以下标准对分子进行了分类:
1) 特异性(即,单特异性或双特异性/多特异性);
2)偶联状态(即抗体-药物偶联物(ADC,这里仅限于与细胞毒性药物偶联的抗体),放射免疫治疗(包括放射免疫偶联物(RIC)和抗体螯合剂conjugates)和免疫偶联物(即,不包括在ADC或放射免疫治疗组中的抗体偶联物由融合到非免疫球蛋白衍生蛋白结构域的抗体组成);
3)组成(即一个分子或混合物)。在我们的分析中,每个分子只表示根据修饰对分子性质的改变程度进行分类。因此,ADC组包括双特异性ADC,放射免疫治疗组包括双特异性ADC放射免疫疗法,免疫偶联物组包括免疫偶联物混合物。
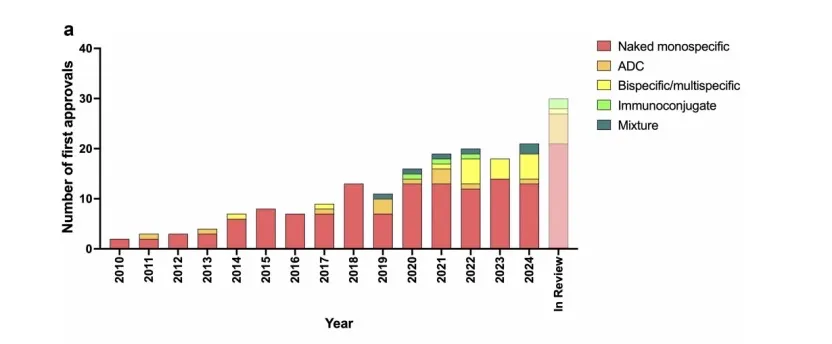
我们确定了30种研究性(即未在任何国家批准上市)抗体疗法,其上市申请,包括在美国提交的BLA,在欧盟提交的上市授权申请,以及在中国提交的新药申请(NDA)有正在接受至少一个监管机构的审查,截至我们最后一次更新是在2024年12月9日(表2)其中13项申请正在美国或中国接受审查欧盟和其他可能的国家,而17个正在进行只在中国审查。16份申请用于非癌症适应症,14份用于癌症适应症。相关的细节这些分子按它们的顺序总结如下如表2所示。
2024年由国内自主研发企业申请获批上市抗体类产品有11款,具体如下:
兴盟生物医药(苏州)有限公司自主研发和生产的1类创新药泽美洛韦玛佐瑞韦单抗注射液(克瑞毕®),抗狂犬病鸡尾酒单抗。
恒瑞医药子公司苏州盛迪亚生物医药有限公司自主研发的 1 类新药IL-17A抑制剂夫那奇珠单抗注射液上市,用于治疗适合接受系统治疗或光疗的中重度斑块状银屑病的成人患者。
重庆智翔金泰生物制药股份有限公司自主研发的I类新药重组全人源抗IL-17单克隆抗体赛立奇单抗注射液(金立希®),用于中、重度斑块状银屑病的治疗。
由康诺亚生物医药科技(成都)有限公司自主研发的1类新药IL-4Rα抗体药物康悦达(司普奇拜单抗注射液)获得国家药品监督管理局(NMPA)批准上市,用于治疗慢性鼻窦炎伴鼻息肉。
伊喜宁®(伊努西单抗注射液)是中山康方生物医药有限公司自主开发创新的PCSK9单克隆抗体新药,于2024年9月获批上市,主要用于治疗原发型高胆固醇血症和混合型高脂血症。
上海君实生物医药科技股份有限公司自主研发的昂戈瑞西单抗注射液(重组人源化抗PCSK9单克隆抗体注射液,商品名:君适达®)的上市许可申请获得批准,用于治疗原发性高胆固醇血症(非家族性)和混合型血脂异常的成人患者。
石药集团开发的治疗用生物制品1类新药重组抗PD-1全人源单克隆抗体恩朗苏拜单抗注射液(商品名:恩舒幸®)获批上市,用于治疗至少一线含铂方案化疗失败的PD-L1表达阳性的复发或转移性宫颈癌患者。
齐鲁制药艾帕洛利托沃瑞利单抗注射液(齐倍安®)获得国家药品监督管理局上市批准,用于治疗复发或转移性宫颈癌。艾帕洛利托沃瑞利单抗注射液是全球首个获批上市的PD-1/CTLA-4双功能组合抗体,由IgG4型PD-1抗体和IgG1型CTLA-4抗体按照特定的比例组成。
正大天晴药业集团申报的1类创新药贝莫苏拜单抗注射液Benmelstobart (TQB2450)(商品名“安得卫”)首个适应症国家药品监督管理局(NMPA)批准上市,联合盐酸安罗替尼胶囊、卡铂和依托泊苷用于广泛期小细胞肺癌(ES-SCLC)患者的一线治疗,贝莫苏拜单抗注射液是一款新型的人源化抗程序性死亡配体-1(PD-L1)单抗。
依达方®是康方生物自主研发的、全球首创PD-1/VEGF双特异性肿瘤免疫治疗药物。适应症联合化疗用于经表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)治疗进展的EGFR突变的局部晚期或转移性非鳞非小细胞肺癌(nsq-NSCLC),依达方®是全球首个获批上市的“肿瘤免疫+抗血管生成“协同抗肿瘤机制的双特异性抗体新药。
四川科伦博泰生物医药股份有限公司首个自主原研TROP2 ADC芦康沙妥珠单抗(sac-TMT,佳泰莱®)的上市申请,用于既往至少接受过2种系统治疗(其中至少1种治疗针对晚期或转移性阶段)的不可切除的局部晚期或转移性三阴性乳腺癌成人患者。
信息来源:Antibodies to watch in 2025 https://doi.org/10.1080/19420862.2024.2443538
关键词:
对照药 | 抗药抗体 | 仪器 | 试剂



